FAQ des enjeux sociaux et éthiques
Préparé par l'infrastructure Enjeux socio-éthiques et juridiques des thérapies cellulaires et tissulaires
(mise à jour 18 novembre 2019)
| Quels sont les enjeux sociaux et éthiques soulevés par les cellules souches? |
|
|
Il y a plusieurs enjeux à considérer lorsqu'on pense à la recherche avec les cellules souches. Celle-ci soulève des questions quant à la vie privée, le consentement, le droit de propriété et la commercialisation. Bien que ces enjeux soient de portée générale, ils ne sont pas uniques à la recherche avec les cellules souches, mais sont habituellement soulevés par la recherche biomédicale en général. (1) Voir Padma Nambisan, “Chapter 3 – Stem Cell Research,” in An Introduction to Ethical, Safety and Intellectual Property Rights Issues in Biotechnology (Elsevier Inc, 2017). (2) Voir Sarah Chan, "Current and emerging global themes in the bioethics of regenerative medicine: the tangled web of stem cell translation." Regenerative medicine 12.7 (2017): 839-851. |
|
| Est-ce que les thérapies à base de cellules souches sont prêtes pour la clinique? | |
|
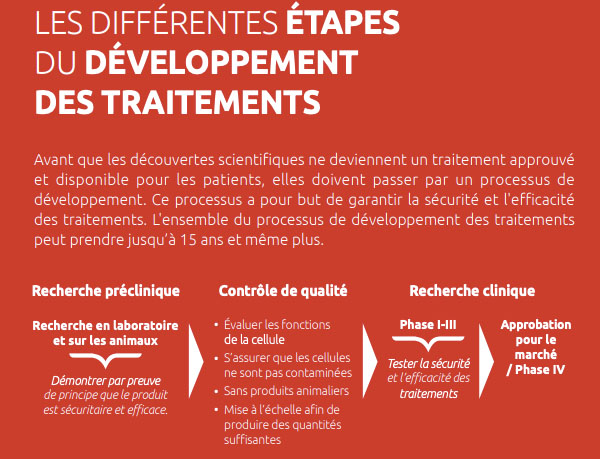
En dépit des réussites dans le domaine de la recherche avec les cellules souches, l'étendue des maladies pour lesquelles existent des traitements efficaces à base de cellules souches demeure limitée. À date, deux produits de thérapie cellulaire ont été approuvé au Canada, dont Prochymal et Kymriah. Même si les cellules souches ont elles-mêmes créées de l'espoir pour de nouveaux traitements contre les maladies, les traitements à base de cellules souches demeurent au stade préliminaire de la découverte et de l’utilisation en clinique. Jusqu'à maintenant, la recherche avec les cellules souches s'est largement concentrée sur l'identification, l'isolement et la différenciation des cellules souches in vitro. Avant qu'on ne puisse développer des thérapies à base de cellules souches efficaces, il reste encore beaucoup à apprendre sur la survie, la division et l'intégration des cellules souches dans un nouvel environnement tissulaire.
|
|
| Pourquoi est-il nécessaire de réglementer les technologies à base de cellules souches? | |
| L'objectif principal de la réglementation de produits thérapeutiques est d'assurer qu'ils sont efficaces et de haute qualité, et que leur usage est sécuritaire, afin de protéger la santé et la sécurité d'éventuels consommateurs ou patients. Tout produit thérapeutique comporte des risques qui doivent être évalués par rapport à leurs avantages potentiels. En raison des caractéristiques et de l'état émergent de la technologie, prendre en compte l'ensemble des enjeux de sécurité, d'efficacité et de qualité liés aux produits à base de cellules souches peut constituer un défi pour les organismes régulateurs (ex. Santé Canada, U.S. Food and Drug Administration, et l’Agence européenne des médicaments). Ces enjeux incluent les risques de sécurité pendant le traitement et le stockage de produits, les risques de contamination, le risque d'infection potentiel, le risque de formation de tumeurs et le risque de rejet immunologique. | |
| En quoi consiste une évaluation éthique et pourquoi est-elle nécessaire? | |
|
Avant d'amorcer toute étude clinique impliquant des humains, la recherche doit recevoir l'approbation éthique de l'institution où la recherche aura lieu afin d'assurer que les participants seront dûment protégés. Bref, une évaluation par le comité d’éthique de la recherche (CER) a pour but d’assurer l’acceptabilité éthique des recherches avec des êtres humains. Le CER est composé d'experts indépendants en science, en recherche clinique, en éthique, en droit, ainsi que des représentants du public/des patients analyserons les aspects éthiques du projet de recherche dans le but d'assurer la protection des participants. Il est à noter que si la recherche est avec des cellules souches pluripotentes humaines qui ont été dérivées d’une source embryonnaire ou qui seront transférées chez des êtres humains ou des animaux, elle devra être évaluée et approuvée préalablement par le Comité de surveillance de la recherche sur les cellules souches (CSRCS), qui a été mis sur pied par les Instituts de recherche en santé du Canada (IRSC) (art. 12.10 EPTC 2 (2018)). Cette preuve d’approbation devra ensuite être fournit au CER. (3) Conseil de recherches en sciences humaines, Conseil de recherches en sciences naturelles et en génie du Canada, Instituts de recherche en santé du Canada (2018). Énoncé de politique des trois conseils : Éthique de la recherche avec des êtres humains – EPTC 2. Disponible : http://www.pre.ethics.gc.ca/fra/policy-politique_tcps2-eptc2_2018.html. |
|
| Quels sont les politiques et les documents de principes internationaux clés qui abordent la recherche avec les cellules souches? | |
|
L'ISSCR est un organisme qui facilite la collaboration internationale des chercheurs dans le domaine des cellules souches. L'ISSCR cherche à harmoniser les principes éthiques à travers l'adoption des « Guidelines for Stem Cell Research and Clinical Translation » (2016 mise à jour 2021). Axées sur l’intégrité de la recherche, la primauté du bien-être des patients, la transparence et la justice sociale, ces lignes directrices encouragent des pratiques responsables, transparentes et uniformes à l'échelle mondiale. Ces lignes directrices encouragent la communauté de recherche à communiquer avec le public de façon responsable et de transmettre des renseignements justes reliés au progrès, les échecs, les bénéfices et les risques de la recherche avec les cellules souches. Elles incluent des standards pour les données de recherche et imposent un processus de surveillance spécialisé pour les projets de recherche portant sur les cellules souches, qui soulèvent des questions éthiques. De plus, ce document décrit qu’un traitement potentiel à base de cellules souches doit subir des essais cliniques rigoureux avant qu’une autorisation de vente puisse être accordée. Enfin, elles soulignent aussi l’importance d’assurer le consentement éclairé des donneurs de matériaux biologiques dans le contexte de recherche et dans l’application clinique des cellules souches. • The ISSCR Releases Updated Guidelines for Stem Cell Research and Clinical Translation https://www.isscr.org/news-publicationsss/isscr-news-articles/article-listing/2021/05/26/the-isscr-releases-updated-guidelines-for-stem-cell-research-and-clinical-translation |
|
| Quelles sont les politiques internationales clés pour la réglementation des thérapies à base de cellules souches et des essais cliniques? | |
|
Les principes directeurs de l'Organisation Mondiale de la Santé (OMS) sur la transplantation de cellules, de tissus et d'organes humains (2010) fournissent un cadre éthique pour l'approvisionnement et la transplantation de cellules, tissus et organes humains pour des fins thérapeutiques.
|
|
| Quel est l'encadrement normatif gouvernant la recherche avec les cellules souches au Canada? | |
| L'encadrement normatif canadien gouvernant les cellules souches se limite principalement au contexte de la recherche, notamment en lien avec les embryons humains. Pour avoir un aperçu complet de l'encadrement en matière de recherche sur les cellules souches, il faut tenir compte de différentes lois et lignes directrices : • La Loi sur la procréation assistée (2004) autorise la recherche avec les cellules souches à l’intérieur d’un cadre défini. Elle interdit le clonage (art. 5(1)(a)), ainsi que la création d'embryons pour des fins de recherche (art. 5(1)(b)). Une personne qui contrevient à l’article 5 peut encourir une amende jusqu’à $500,000 et une peine de prison jusqu’à 10 ans, ou l’une de ces sanctions (art. 60). Cependant, la Loi permet l’utilisation des embryons créés dans le cadre de la procréation assistée, mais qui ne sont plus requis pour cet usage. De même, elle permet la dérivation de cellules souches issus de tels embryons humains. L’utilisation de ces embryons excédentaires est permise à condition que les donneurs d’embryons et les donneurs de gamètes ont consentit à l’utilisation de ceux-ci à des fins de recherche (art. 8). • L’Énoncé de politique des trois Conseils : Éthique de la recherche avec des êtres humains – EPTC 2 (2018) est une politique commune du Conseil de recherches en sciences humaines, le Conseil de recherches en sciences naturelles et en génie du Canada et les Instituts de recherche en santé du Canada. Le Chapitre 12F de l'EPTC 2 porte sur la « Recherche avec des cellules souches pluripotentes ». Ce chapitre établit les balises et les critères de recherche. Par exemple, il faut obtenir le consentement des donneurs d’embryons à nouveau avant de débuter la recherche avec des cellules souches (art. 12.12 EPTC 2 (2018)). Le CSRCS veille à la conformité de tels projets avec l’EPTC 2. Bref, les projets de recherche avec des cellules souches pluripotentes humaines qui ont été dérivées d’une source embryonnaire ou qui seront transférées chez des êtres humains ou des animaux, devraient être évaluée et approuvée par le CSRCS (art. 12.10 EPTC 2 (2018)). Cette preuve d’approbation devra ensuite être fournit au CER institutionnel. L’évaluation mené par le CSRCS au niveau national et celle conduite par le CER au niveau local se déroulent en parallèle. De plus, le CSRCS a un rôle consultatif concernant les conséquences scientifiques, éthiques, légales et sociales de la recherche avec les cellules souches humaines, ainsi que par rapport aux applications cliniques potentielles de cette recherche. L’EPTC 2 (2018) propose la création d'un registre national de lignées de cellules souches embryonnaires générées au Canada, qui serait accessible électroniquement (art. 12.15 EPTC 2 (2018)). Enfin, toutes les cellules ou lignées cellulaires humaines devraient être codifiés ou anonymisés avant leur livraison (art. 12.16-12.17 EPTC 2 (2018)). |
|
| Quel est l'encadrement normatif gouvernant les thérapies à base de cellules souches au Canada? | |
|
Au Canada, l'examen et l'approbation des essais cliniques impliquant les produits thérapeutiques, incluant les produits à base de cellules souches, relèvent de la responsabilité de la Direction générale des produits de santé et des aliments (DGPSA) de Santé Canada, établie en vertu de la Loi sur les aliments et drogues (LAD) (1985). Au sein de la DGPSA, des essais cliniques impliquant des drogues « pharmaceutiques » et des « dispositifs médicaux » relèvent de l'autorité de la Direction des produits thérapeutiques (DPT), alors que les essais cliniques impliquant les drogues biologiques ou « produits biologiques » relèvent de la responsabilité de la Direction des produits biologiques et des thérapies génétiques (DPTBTG).
Pour plus de renseignements, voir les trois documents d’orientation publiés par Santé Canada et un survol du contexte canadien : |
|
| Quel est l'encadrement normatif gouvernant les cellules souches au Québec? | |
|
Présentement, il n'y a pas de cadre normatif québécois spécifique relative aux cellules souches. Donc, c'est l'encadrement fédéral qui s'applique. Toutefois, les dispositions générales du Code Civil du Québec ayant trait à la recherche avec des humains et l'utilisation des tissus humains pourraient s'appliquer indirectement à la recherche avec les cellules souches embryonnaires humaines (art. 11 à 25 C.c.Q.). |
|
|
Ressources utiles: - ISSCR. Stem Cell Facts – https://www.closerlookatstemcells.org/wp-content/uploads/2018/10/stem-cell-facts.pdf
- ISSCR. Stem Cell Treatments: What to Ask – https://www.closerlookatstemcells.org/stem-cells-medicine/stem-cell-treatments-what-to-ask/
- Ontario Institute for Regenerative Medicine (OIRM). About Stem Cell Therapies – https://oirm.ca/for-patients/about-stem-cell-therapies/
- National Institutes of Health (NIH). Stem Cell Information – https://stemcells.nih.gov/info.htm
- EuroStemCell. Education Resources – https://www.eurostemcell.org/education-resources
- RegMedNet. Ethics & Policy – https://www.regmednet.com/channels/195-ethics-policy
|